तत्वों को या तो वर्गीकृत किया जा सकता है धातु या अधातु उनके गुणों के आधार पर। ज्यादातर समय, आप बता सकते हैं कि एक तत्व केवल एक धातु है जो इसके धातु चमक को देखकर है, लेकिन तत्वों के इन दो सामान्य समूहों के बीच यह एकमात्र अंतर नहीं है।
धातु
अधिकांश तत्व धातु हैं। इसमें क्षार धातु, क्षारीय पृथ्वी धातु, संक्रमण धातु, लैंथेनाइड, और एक्टिनाइड शामिल हैं। पर आवर्त सारणीधातुओं को कार्बन, फास्फोरस, सेलेनियम, आयोडीन और रेडॉन के माध्यम से एक ज़िग-ज़ैग लाइन द्वारा नॉनमैटल से अलग किया जाता है। ये तत्व और उन के अधिकार के लिए गैर-समरूप हैं। लाइन के बाईं ओर के तत्वों को समाप्त किया जा सकता है धातू या अर्धचालक और उन धातुओं और अधातुओं के बीच में मध्यवर्ती गुण होते हैं। धातुओं और अधातुओं के भौतिक और रासायनिक गुणों का उपयोग उन्हें अलग बताने के लिए किया जा सकता है।
धातु भौतिक गुण:
- चमकदार (चमकदार)
- अच्छा कंडक्टर गर्मी और बिजली की
- उच्च गलनांक
- उच्च घनत्व (उनके आकार के लिए भारी)
- निंदनीय (अंकित किया जा सकता है)
- नमनीय (तारों में खींचा जा सकता है)
- आमतौर पर ठोस कमरे का तापमान (एक अपवाद पारा है)
- एक पतली शीट के रूप में अपारदर्शी (धातुओं के माध्यम से नहीं देख सकते हैं)
- जब धातु टकराते हैं तो धातुएं सोनोरस होती हैं या घंटी जैसी आवाज करती हैं
धातु रासायनिक गुण:
- प्रत्येक धातु परमाणु के बाहरी आवरण में 1-3 इलेक्ट्रॉन होते हैं और इलेक्ट्रॉनों को आसानी से खो देते हैं
- कोरोड आसानी से (जैसे, ऑक्सीकरण से क्षतिग्रस्त हो जाता है जैसे कि धूमिल या जंग)
- आसानी से इलेक्ट्रान खो देते हैं
- फॉर्म ऑक्साइड जो बुनियादी हैं
- Fave लोअर इलेक्ट्रोनगेटिविटीज
- अच्छे कम करने वाले एजेंट हैं
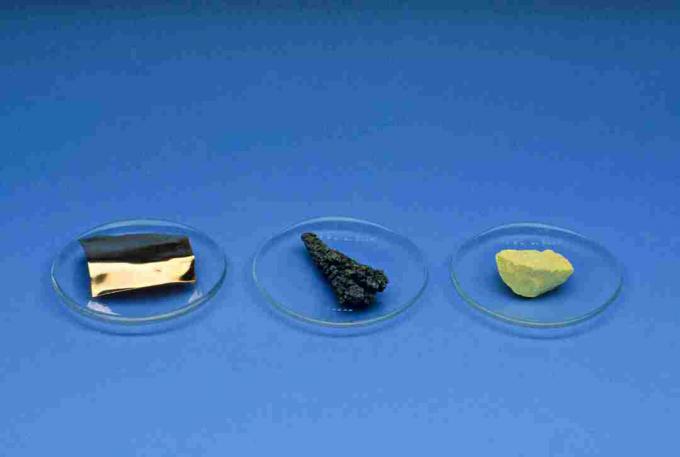
nonmetals
nonmetalsहाइड्रोजन के अपवाद के साथ, आवर्त सारणी के दाईं ओर स्थित हैं। ऐसे तत्व जो अधातु हैं, वे हैं हाइड्रोजन, कार्बन, नाइट्रोजन, फास्फोरस, ऑक्सीजन, सल्फर, सेलेनियम, सभी हैलोजेन और कुलीन गैसें।
अधातु भौतिक गुण:
- चमकदार नहीं (सुस्त उपस्थिति)
- गर्मी और बिजली के खराब संवाहक
- गैर-ठोस ठोस
- भंगुर ठोस
- कमरे के तापमान पर ठोस, तरल पदार्थ या गैसें हो सकती हैं
- एक पतली चादर के रूप में पारदर्शी
- नॉनमैटल सोनोरस नहीं हैं
अधातु रासायनिक गुण:
- आमतौर पर उनके बाहरी आवरण में 4-8 इलेक्ट्रॉन होते हैं
- वेलेंस इलेक्ट्रॉनों को आसानी से हासिल या साझा करें
- फार्म ऑक्साइड जो अम्लीय होते हैं
- Have उच्च विद्युतीकरण
- अच्छे हैं ऑक्सीडाइज़िंग एजेंट
धातु और अधातु दोनों अलग-अलग रूप (एलोट्रोप्स) लेते हैं, जिनमें एक-दूसरे से अलग-अलग रूप और गुण होते हैं। उदाहरण के लिए, ग्रेफाइट और डायमंड नोनमेटल कार्बन के दो अलॉट्रोप हैं, जबकि फेराइट और ऑस्टेनाइट लोहे के दो अलॉट्रोप हैं। जबकि अधातुओं में एक अलॉट्रोप हो सकता है जो धात्विक दिखाई देता है, धातुओं के आबंटोप के सभी ऐसे दिखते हैं जैसे हम एक धातु के रूप में सोचते हैं (चमकदार, चमकदार)।