परमाणु और आणविक संरचना
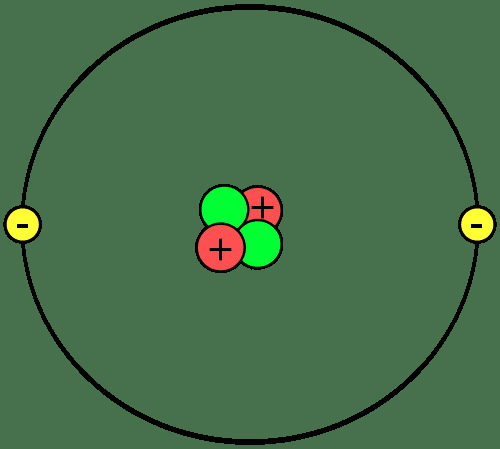
पदार्थ के निर्माण खंड परमाणु होते हैं, जो अणु या यौगिक बनाने के लिए एक साथ जुड़ते हैं। एक परमाणु के भागों को जानना महत्वपूर्ण है, आयन और समस्थानिक क्या हैं, और परमाणु एक साथ कैसे जुड़ते हैं।
एक परमाणु के भाग
परमाणु तीन घटकों से बने होते हैं:
- प्रोटॉन - धनात्मक विद्युत आवेश
- न्यूट्रॉन - कोई विद्युत आवेश नहीं
- इलेक्ट्रॉन - नकारात्मक विद्युत आवेश
प्रोटॉन और न्यूट्रॉन प्रत्येक परमाणु के नाभिक या केंद्र का निर्माण करते हैं। इलेक्ट्रॉन नाभिक की परिक्रमा करते हैं। तो, प्रत्येक परमाणु के नाभिक का शुद्ध धनात्मक आवेश होता है, जबकि परमाणु के बाहरी भाग का शुद्ध ऋणात्मक आवेश होता है। रासायनिक प्रतिक्रियाओं में, परमाणु इलेक्ट्रॉनों को खो देते हैं, प्राप्त करते हैं या साझा करते हैं। नाभिक सामान्य रासायनिक प्रतिक्रियाओं में भाग नहीं लेता है, हालांकि परमाणु क्षय और परमाणु प्रतिक्रियाएं परमाणु नाभिक में परिवर्तन का कारण बन सकती हैं।
परमाणु, आयन और आइसोटोप
एक परमाणु में प्रोटॉनों की संख्या निर्धारित करती है कि यह कौन सा तत्व है। प्रत्येक तत्व में एक- या दो अक्षर होते हैं
प्रतीक इसका उपयोग रासायनिक सूत्रों और प्रतिक्रियाओं में इसकी पहचान करने के लिए किया जाता है। हीलियम का प्रतीक वह है। दो प्रोटॉन के साथ एक परमाणु एक हीलियम परमाणु है चाहे उसके कितने न्यूट्रॉन या इलेक्ट्रॉन हों। एक परमाणु में प्रोटॉन, न्यूट्रॉन और इलेक्ट्रॉनों की समान संख्या हो सकती है या न्यूट्रॉन और / या इलेक्ट्रॉन की संख्या प्रोटॉन की संख्या से भिन्न हो सकती है।शुद्ध सकारात्मक या नकारात्मक विद्युत आवेश को वहन करने वाले परमाणु हैं आयनों. उदाहरण के लिए, यदि एक हीलियम परमाणु दो इलेक्ट्रॉनों को खो देता है, तो इसका शुद्ध आवेश +2 होगा, जिस पर लिखा होगा ...।2+.
एक परमाणु में न्यूट्रॉन की संख्या को निर्धारित करना जो निर्धारित करता है आइसोटोप एक तत्व यह है परमाणु को उनके आइसोटोप की पहचान करने के लिए परमाणु प्रतीकों के साथ लिखा जा सकता है, जहां नाभिकों की संख्या (प्रोटॉन प्लस न्यूट्रॉन) एक तत्व प्रतीक के ऊपर और बाईं ओर सूचीबद्ध है, नीचे सूचीबद्ध प्रोटॉन की संख्या और बाईं ओर प्रतीक। उदाहरण के लिए, हाइड्रोजन के तीन समस्थानिक हैं:
11एच, 21एच, 31एच
चूंकि आप जानते हैं कि किसी तत्व के परमाणु के लिए प्रोटॉन की संख्या कभी नहीं बदलती है, इसलिए आइसोटोप अधिक सामान्यतः तत्व प्रतीक और न्यूक्लियनों की संख्या का उपयोग करके लिखे जाते हैं। उदाहरण के लिए, आप यूरेनियम के दो सामान्य समस्थानिकों के लिए हाइड्रोजन या U-236 और U-238 के तीन समस्थानिकों के लिए H-1, H-2 और H-3 लिख सकते हैं।
परमाणु संख्या और परमाणु भार
परमाणु क्रमांक एक परमाणु अपने तत्व और उसके प्रोटॉन की संख्या की पहचान करता है। परमाण्विक भार प्रोटॉन की संख्या प्लस एक तत्व में न्यूट्रॉन की संख्या है (क्योंकि इलेक्ट्रॉनों का द्रव्यमान प्रोटॉन और न्यूट्रॉन की तुलना में इतना छोटा है कि यह अनिवार्य रूप से गिनती नहीं करता है)। परमाणु भार को कभी-कभी परमाणु द्रव्यमान या परमाणु द्रव्यमान संख्या कहा जाता है। हीलियम की परमाणु संख्या 2 है। हीलियम का परमाणु भार 4 है। ध्यान दें कि आवर्त सारणी पर एक तत्व का परमाणु द्रव्यमान एक पूर्ण संख्या नहीं है। उदाहरण के लिए, हीलियम का परमाणु द्रव्यमान 4 के बजाय 4.003 दिया गया है। ऐसा इसलिए है क्योंकि आवर्त सारणी एक तत्व के समस्थानिकों की प्राकृतिक प्रचुरता को दर्शाती है। रसायन विज्ञान की गणना में, आप आवधिक तालिका पर दिए गए परमाणु द्रव्यमान का उपयोग करते हैं, एक तत्व का एक नमूना मानकर उस तत्व के लिए आइसोटोप की प्राकृतिक सीमा को दर्शाता है।
अणु
परमाणु एक दूसरे के साथ बातचीत करते हैं, अक्सर एक दूसरे के साथ रासायनिक बंधन बनाते हैं। जब दो या दो से अधिक परमाणु एक दूसरे से बंध जाते हैं, तो वे एक अणु का निर्माण करते हैं। एक अणु सरल हो सकता है, जैसे कि एच2, या अधिक जटिल, जैसे कि सी6एच12हे6. ग्राहक एक अणु में प्रत्येक प्रकार के परमाणु की संख्या का संकेत देते हैं। पहला उदाहरण हाइड्रोजन के दो परमाणुओं द्वारा गठित एक अणु का वर्णन करता है। दूसरा उदाहरण कार्बन के 6 परमाणुओं, हाइड्रोजन के 12 परमाणुओं और ऑक्सीजन के 6 परमाणुओं द्वारा गठित एक अणु का वर्णन करता है। जब आप परमाणुओं को किसी भी क्रम में लिख सकते हैं, तो सम्मेलन को पहले एक अणु के सकारात्मक रूप से चार्ज किए गए अतीत को लिखना होता है, इसके बाद अणु के नकारात्मक चार्ज वाले भाग को लिखा जाता है। तो, सोडियम क्लोराइड NaCl लिखा जाता है न कि ClNa।
आवर्त सारणी नोट्स और समीक्षा

आवर्त सारणी रसायन विज्ञान में एक महत्वपूर्ण उपकरण है। ये नोट्स आवर्त सारणी की समीक्षा करते हैं कि यह कैसे व्यवस्थित है, और आवर्त सारणी रुझान।
आवर्त सारणी का आविष्कार और संगठन
1869 में, दिमित्री मेंडेलीव रासायनिक तत्वों को एक आवर्त सारणी में रखा जाता है, जैसा कि हम आज उपयोग करते हैं, उसके तत्वों को छोड़कर बढ़ते हुए परमाणु भार के अनुसार आदेश दिए गए थे, जबकि आधुनिक तालिका परमाणु को बढ़ाकर आयोजित की जाती है नंबर। जिस तरह से तत्वों का आयोजन किया जाता है वह तत्व गुणों में रुझान को देखना और रासायनिक प्रतिक्रियाओं में तत्वों के व्यवहार की भविष्यवाणी करना संभव बनाता है।
पंक्तियों (बाएं से दाएं चलना) को कहा जाता है अवधि. एक अवधि में तत्व एक गैर-उच्चतम इलेक्ट्रॉन के लिए समान उच्चतम ऊर्जा स्तर साझा करते हैं। परमाणु आकार बढ़ने पर प्रति ऊर्जा स्तर अधिक उप स्तर होते हैं, इसलिए तालिका के नीचे अवधि में अधिक तत्व होते हैं।
कॉलम (ऊपर से नीचे की ओर बढ़ते हुए) तत्व के लिए आधार बनाते हैं समूहों. समूहों में तत्व समान संख्या में वैलेंस इलेक्ट्रॉनों या बाहरी इलेक्ट्रॉन शेल व्यवस्था को साझा करते हैं, जो समूह में तत्वों को कई सामान्य गुण प्रदान करता है। तत्व समूहों के उदाहरण क्षार धातु और महान गैस हैं।
आवर्त सारणी रुझान या आवधिकता
आवर्त सारणी का संगठन एक नज़र में तत्वों के गुणों में रुझान देखना संभव बनाता है। महत्वपूर्ण रुझान एक परमाणु त्रिज्या, आयनीकरण ऊर्जा, विद्युत ऊर्जा और इलेक्ट्रॉन संबंध से संबंधित हैं।
-
परमाणु का आधा घेरा
परमाणु त्रिज्या एक परमाणु के आकार को दर्शाता है। परमाणु का आधा घेरा बाएं से दाएं की ओर बढ़ना कम हो जाता है एक अवधि के दौरान और ऊपर से नीचे की ओर बढ़ना एक तत्व समूह। हालाँकि आपको लगता है कि परमाणु अधिक इलेक्ट्रॉनों के रूप में बड़े हो जाएंगे, इलेक्ट्रॉन एक खोल में रहते हैं, जबकि प्रोटॉन की बढ़ती संख्या नाभिक के करीब गोले खींचती है। एक समूह को नीचे ले जाने पर, नए ऊर्जा के गोले में नाभिक से इलेक्ट्रॉन अधिक पाए जाते हैं, इसलिए परमाणु का समग्र आकार बढ़ता है। -
आयनीकरण ऊर्जा
आयनियोजन ऊर्जा, गैस अवस्था में आयन या परमाणु से एक इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा की मात्रा है। आयनीकरण ऊर्जा बाएं से दाएं की ओर बढ़ना एक अवधि के दौरान और ऊपर से नीचे की ओर बढ़ना कम हो जाता है नीचे एक समूह। -
वैद्युतीयऋणात्मकता
इलेक्ट्रोनगेटिविटी एक उपाय है कि कितनी आसानी से एक परमाणु एक रासायनिक बंधन बनाता है। इलेक्ट्रोनगेटिविटी जितनी अधिक होगी, एक इलेक्ट्रॉन को बांधने का आकर्षण उतना ही अधिक होगा। वैद्युतीयऋणात्मकता एक तत्व समूह नीचे जाने से घटता है. आवर्त सारणी के बायीं ओर के तत्व इलेक्ट्रोपोसिटिव होते हैं या एक को स्वीकार करने की तुलना में इलेक्ट्रॉन दान करने की अधिक संभावना होती है। -
इलेक्ट्रान बन्धुता
इलेक्ट्रॉन आत्मीयता दर्शाती है कि एक इलेक्ट्रॉन को आसानी से एक परमाणु कैसे स्वीकार करेगा। इलेक्ट्रान बन्धुता तत्व समूह के अनुसार बदलता रहता है. महान गैसों में शून्य के पास इलेक्ट्रॉन समानताएं होती हैं क्योंकि उनमें इलेक्ट्रॉन के गोले भरे होते हैं। हैलोजेन में उच्च इलेक्ट्रॉन समानताएं होती हैं क्योंकि एक इलेक्ट्रॉन के अलावा एक परमाणु को पूरी तरह से भरा इलेक्ट्रॉन खोल देता है।
रासायनिक बांड और संबंध

रासायनिक बन्ध समझना आसान है कि क्या आप परमाणुओं और इलेक्ट्रॉनों के निम्नलिखित गुणों को ध्यान में रखते हैं:
- परमाणु सबसे स्थिर विन्यास चाहते हैं।
- ऑक्टेट नियम में कहा गया है कि उनके बाहरी कक्ष में 8 इलेक्ट्रॉनों वाले परमाणु सबसे अधिक स्थिर होंगे।
- परमाणु अन्य परमाणुओं के इलेक्ट्रॉनों को साझा, दे या दे सकते हैं। ये रासायनिक बंध के रूप हैं।
- बांड परमाणुओं की वैलेंस इलेक्ट्रॉनों के बीच होते हैं, न कि आंतरिक इलेक्ट्रॉनों के बीच।
रासायनिक बांड के प्रकार
दो मुख्य प्रकार के रासायनिक बंधन आयनिक और सहसंयोजक बंधन हैं, लेकिन आपको संबंध के कई रूपों के बारे में पता होना चाहिए:
-
आयोनिक बांड
आयोनिक बांड फार्म जब एक परमाणु दूसरे परमाणु से एक इलेक्ट्रॉन लेता है। उदाहरण: NaCl एक आयनिक बंध द्वारा निर्मित होता है जहाँ सोडियम क्लोरीन में अपने वैलेंस इलेक्ट्रॉन को दान करता है। क्लोरीन एक हलोजन है। सभी हैलोजन में 7 वैलेंस इलेक्ट्रॉन होते हैं और एक स्थिर ऑक्टेट हासिल करने के लिए एक और की आवश्यकता होती है। सोडियम एक क्षार धातु है। सभी क्षार धातुओं में 1 वैलेंस इलेक्ट्रॉन होता है, जिसे वे आसानी से बॉन्ड बनाने के लिए दान करते हैं। -
सहसंयोजक बांड
सहसंयोजक बांड फार्म जब परमाणु इलेक्ट्रॉनों को साझा करते हैं। वास्तव में, मुख्य अंतर यह है कि आयनिक बांड में इलेक्ट्रॉन एक परमाणु के साथ अधिक निकटता से जुड़े होते हैं नाभिक या दूसरे, एक सहसंयोजक बंधन में इलेक्ट्रॉनों के बारे में समान रूप से एक नाभिक की कक्षा के लिए समान रूप से होने की संभावना है अन्य। यदि इलेक्ट्रॉन एक के साथ एक परमाणु से अधिक निकटता से जुड़ा है, तो ए ध्रुवीय सहसंयोजक बंधन बन सकता है। उदाहरण: पानी में हाइड्रोजन और ऑक्सीजन के बीच सहसंयोजक बंधन, H2ओ -
धात्विक बंधन
जब दो परमाणु दोनों धातु होते हैं, तो एक धातु बंधन बनता है। एक धातु में अंतर यह है कि इलेक्ट्रॉन किसी भी धातु के परमाणु हो सकते हैं, केवल एक यौगिक में दो परमाणु नहीं। उदाहरण: धातुई बांड को शुद्ध तात्विक धातुओं के नमूनों में देखा जाता है, जैसे सोना या एल्यूमीनियम, या मिश्र धातु, जैसे पीतल या कांस्य।
आप सोच रहे होंगे कि आप कैसे बता सकते हैं कि कोई बंधन आयनिक है या सहसंयोजक। आप आवर्त सारणी या तत्वों की तालिका पर तत्वों के प्लेसमेंट को देख सकते हैं electronegativities बांड के प्रकार की भविष्यवाणी करेगा। यदि इलेक्ट्रोनगेटिविटी मान एक दूसरे से बहुत अलग हैं, तो एक आयनिक बंधन बनेगा। आमतौर पर, धनायन एक धातु है और आयन एक अधातु है। यदि तत्व दोनों धातु हैं, तो धातु के बंधन के बनने की अपेक्षा करें। यदि इलेक्ट्रोनगेटिविटी मान समान हैं, तो एक सहसंयोजक बंधन की अपेक्षा करें। दो अधातुओं के बीच के बंधन सहसंयोजक बंधन होते हैं। ध्रुवीय सहसंयोजक बंधन उन तत्वों के बीच बनते हैं, जिनमें इलेक्ट्रोनगेटिविटी मूल्यों के बीच अंतर होता है।
यौगिकों का नाम कैसे करें - रसायन विज्ञान नामकरण
रसायनज्ञ और अन्य वैज्ञानिकों के लिए एक दूसरे के साथ संवाद करने के लिए, इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री या IUPAC द्वारा नामकरण या नामकरण की एक प्रणाली पर सहमति व्यक्त की गई थी। आपने रसायनों को उनके सामान्य नाम (जैसे, नमक, चीनी और बेकिंग सोडा) सुना होगा, लेकिन प्रयोगशाला में आप व्यवस्थित नाम (जैसे, सोडियम क्लोराइड, सूक्रोज और सोडियम बाइकार्बोनेट) का उपयोग करेंगे। यहाँ नामकरण के बारे में कुछ प्रमुख बिंदुओं की समीक्षा की गई है।
नामकरण बाइनरी कम्पाउंड्स
यौगिक केवल दो तत्वों (बाइनरी कम्पाउंड) या दो से अधिक तत्वों से बने हो सकते हैं। बाइनरी कंपाउंड का नामकरण करते समय कुछ नियम लागू होते हैं:
- यदि तत्वों में से एक धातु है, तो इसे पहले नाम दिया गया है।
- कुछ धातुएँ एक से अधिक धनात्मक आयन बना सकती हैं। रोमन अंकों का उपयोग करके आयन पर आवेश बताना आम बात है। उदाहरण के लिए, FeCl2 लोहा (II) क्लोराइड है।
- यदि दूसरा तत्व एक अधातु है, यौगिक का नाम धातु नाम है जिसके बाद अधातु नाम का एक तना (संक्षिप्त नाम) उसके बाद "विचार" होता है। उदाहरण के लिए, NaCl को सोडियम क्लोराइड नाम दिया गया है।
- दो अधातुओं से मिलकर बने यौगिकों के लिए, अधिक विद्युतीय तत्व का नाम पहले रखा गया है। दूसरे तत्व के तने को नाम दिया गया है, उसके बाद "आइड" है। एक उदाहरण एचसीएल है, जो हाइड्रोजन क्लोराइड है।
नामकरण आयनिक यौगिक
द्विआधारी यौगिकों के नामकरण के नियमों के अलावा, आयनिक यौगिकों के लिए अतिरिक्त नामकरण परंपराएं हैं:
- कुछ पॉलीआटोमिक आयनों में ऑक्सीजन होता है। यदि कोई तत्व दो ऑक्जेनियन बनाता है, तो कम ऑक्सीजन वाला एक-इन समाप्त हो जाता है, जबकि अधिक ऑक्जेनियन युक्त होता है। उदाहरण के लिए:
नहीं2- नाइट्राइट है
नहीं3- नाइट्रेट है